Fuerza Ion-Dipolo, Dipolo-Dipolo
FUERZA ION-DIPOLO
La interacción ion-dipolo es una fuerza intermolecular que
se da cuando los iones de una sustancia
interactúan con los dipolos de una molécula covalente polar.
En un enlace polar,
el átomo con mayor electronegatividad atrae los electrones hacia sí, generando
un dipolo negativo en torno a sí mismo, mientras que se forma un dipolo
positivo en el área del átomo con menor electronegatividad.
En la interacción ion-dipolo, el catión sufre atracción
electrostática por el dipolo negativo, mientras que el anión es atraído por la
fuerza electrostática hacia el dipolo positivo.
El clásico ejemplo de la interacción ión-dipolo es la
solución acuosa de cloruro de sodio (NaCl). En esta sal, el enlace es iónico.
Entonces cuando se disuelve en agua, se disocia completamente en cationes Na+ y
aniones Cl-.
La energía de interacción (E), entre un ion y un dipolo,
depende de la carga del ion (Q), de la distancia entre ellos (d) y del momento
dipolar (m) de la molécula polar, según la siguiente fórmula:
FUERZA DIPOLO-DIPOLO
Una atracción dipolo-dipolo es una interacción no covalente
entre dos moléculas polares o dos grupos polares de la misma molécula si ésta
es grande.
Las moléculas que son dipolos se atraen entre sí cuando la
región positiva de una está cerca de la región negativa de la otra entre moléculas de BrCl.
En un líquido las moléculas están muy cercanas entre sí y
se atraen por sus fuerzas intermoleculares. Las moléculas deben tener
suficiente energía para vencer esas fuerzas de atracción, y hacer que el
líquido pueda entrar en ebullición.
Las fuerzas dipolo-dipolo son generalmente más débiles que
las fuerzas ion - dipolo.
En moléculas con masas y tamaños aproximados, la intensidad
de las fuerzas dipolo-dipolo aumenta al incrementarse la polaridad (aumenta el
momento dipolar).
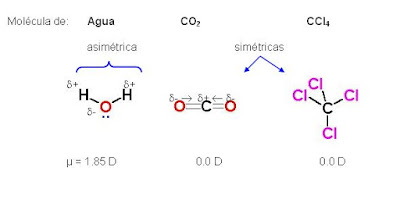
El momento dipolar (m) es un vector (orientado hacia la
carga negativa y cuya magnitud depende de la intensidad de la carga y de la
distancia entre los átomos) que permite cuantificar la asimetría de cargas en
la molécula (Figura inferior izquierda). La forma de la molécula también afecta
al momento dipolar.
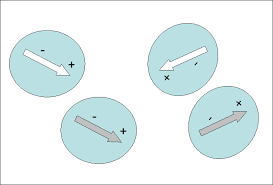
Cuando dos moléculas polares (dipolos) se aproximan, se
produce una atracción entre el polo positivo de una de ellas y el negativo de
la otra. Esta fuerza de atracción entre dos dipolos es tanto más intensa cuanto
mayor es la polarización de dichas moléculas polares o, dicho de otra forma,
cuanto mayor sea la diferencia de electronegatividad entre los átomos enlazados


Comentarios
Publicar un comentario