"PUENTES DE HIDRÓGENO"
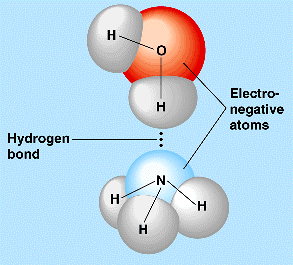
Los puentes de hidrógeno constituyen un caso especial de
interacción dipolo-dipolo. Se producen cuando un átomo de hidrógeno está unido
covalentemente a un elemento que sea:
•Muy electronegativo y con dobletes electrónicos sin
compartir
•De muy pequeño tamaño y capaz, por tanto, de aproximarse
al núcleo del hidrógeno.
El enlace que forman con el hidrógeno es muy polar y el
átomo de hidrógeno es un centro de cargas positivas que será atraído hacia los
pares de electrones sin compartir de los átomos electronegativos de otras. Se
trata de un enlace débil (entre 2 y 10 Kcal/mol). Sin embargo, como son muy
abundantes, su contribución a la cohesión entre biomoléculas es grande.
La distancia entre los átomos electronegativos unidos mediante un puente de hidrógeno suele ser de unos 3 Å. El hidrógeno se sitúa a 1Å del átomo al que está covalentemente unido y a 2 Å del que cede su e- no apareados.
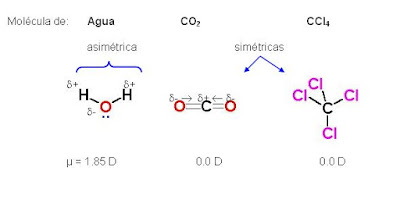
Muchas de las propiedades físicas y químicas del agua se deben a los puentes de hidrógeno. Cada molécula de agua es capaz de formar 4 puentes de hidrógeno, lo que explica su elevado punto de ebullición, ya que es necesario romper gran cantidad de puentes de hidrógeno para que una molécula de agua pase al estado gaseoso.
Este enlace es fundamental en bioquímica, ya que:
•condiciona en gran medida la estructura espacial de las
proteínas y de los ácidos nucleicos y
•está presente en gran parte de las interacciones que
tienen lugar entre distintos tipos de biomoléculas en multitud de procesos
fundamentales para los seres vivos.
http://www.ehu.eus/biomoleculas/moleculas/fuerzas.htm
http://www.ehu.eus/biomoleculas/moleculas/fuerzas.htm




Comentarios
Publicar un comentario