Fuerzas De Van Der Waals
"FUERZAS DE VAN DER WAALS"
Lo primero que tenemos que saber es que las sustancias químicas son formadas por moléculas compuestas de átomos, unidos entre sí por medio de enlaces químicos (covalente, iónico o metálico).
La energía almacenada por estos enlaces, sumada a la red molecular de todo el conjunto de moléculas que forma la sustancia, determina la estabilidad de estos enlaces.
Piensa que si en varias moléculas, por ejemplo con enlaces covalente, no hubiera ninguna fuerza de unión entre ellas, estarían moviéndose libremente y por lo tanto siempre estarían en estado gaseoso (movimiento libre de las moléculas).
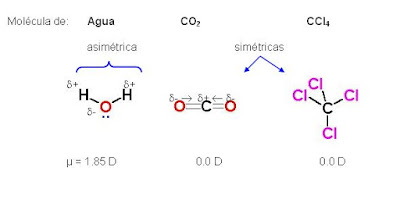
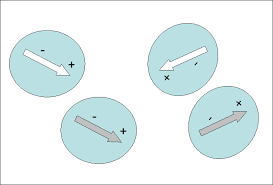
Las fuerzas de van der Waals son fuerzas de estabilización molecular (dan estabilidad a la unión entre varias moléculas), también conocidas como atracciones intermoleculares o de largo alcance y son las fuerzas entre moléculas (fuerzas entre molecula-molecula).
Son fuerzas más débiles que las internas que unen la molécula ya que dependen exclusivamente del tamaño y forma de la molécula pudiendo ser de atracción o de repulsión. Son tan débiles que no se las puede considerar un enlace, como el enlace covalente o iónico, solo se las considera una atracción.
Para tener una idea de la poca fuerza que tienen, si un enlace covalente tuviera una fuerza de 100, las de Van der Waals serían de valor 1 (100 veces menor).
De hecho las fuerzas de van der Waals son las fuerzas atractivas o repulsivas entre moléculas (o entre partes de una misma molécula) distintas a aquellas debidas a un enlace (covalente, iónico o metálico). Incluyen a atracciones entre átomos, moléculas y superficies fuera de los enlaces normales.


Comentarios
Publicar un comentario